药物临床试验机构简介
郴州市第四人民医院于2021年10月正式通过国家药物临床试验机构备案(备案号:药临床机构备字2021000131),备案的临床专业包括心血管内科、泌尿外科、妇科、呼吸内科、神经外科5个专业,可承担Ⅱ、Ⅲ、Ⅳ期药物临床试验。
医院药物临床试验管理机构组织结构完善,拥有伦理委员会,独立行使职能,审查研究者的资质、受试者在临床试验过程中可能的风险和受益,保障受试者的权益和安全。
机构下设药物临床试验机构办公室,设有机构办公室主任、副主任、秘书、质控员、药品管理员与资料管理员,负责药物临床试验工作的日常管理。
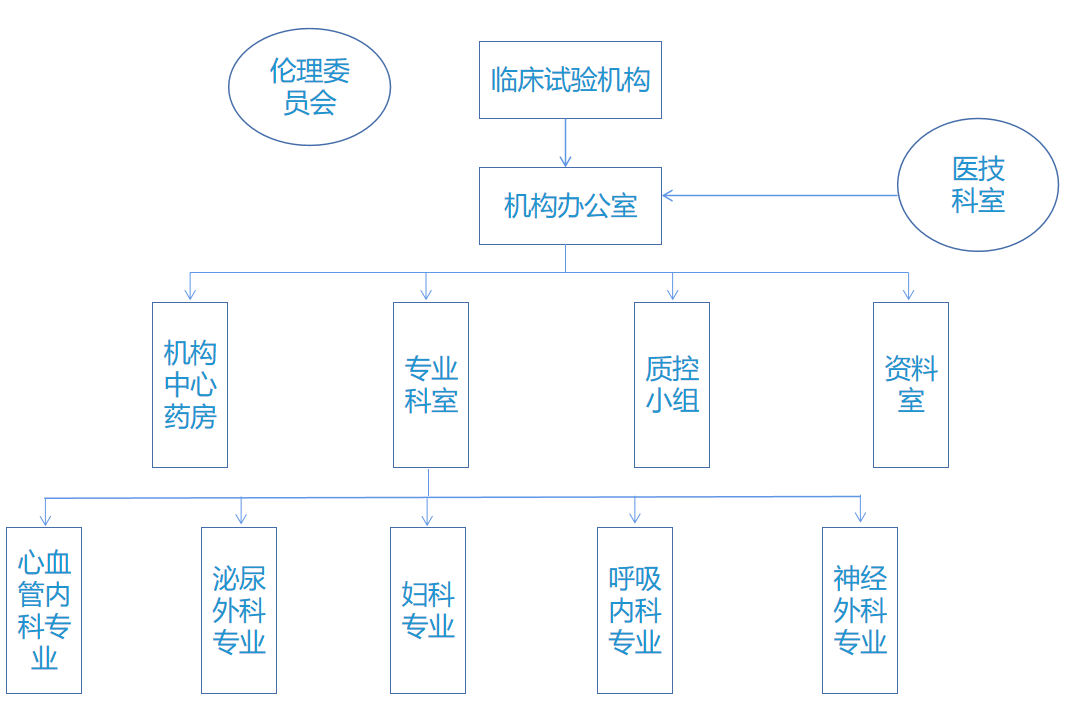
药物临床试验机构按照《药物临床试验质量管理规范》要求及临床试验相关法律法规要求,结合医院的实际情况及相关工作流程,制定了一套完整的临床试验管理制度及标准操作规程,确保各项临床试验项目高质量地完成。
每个专业科室均具有承担药物临床试验相适应的床位数,病源及病种能满足临床试验的需求,急救设施及抢救药物齐全,能保障受试者的安全。研究人员定期参加药物临床试验相关法律法规及操作技术的培训。
机构将依托医院雄厚的技术力量和医疗条件,以严谨的科研态度、标准化操作规程和严格的监管制度,为申办方和其他合作方提供良好的临床试验服务,通过高效的质量管理,保证试验过程规范,试验结果真实可靠,受试者的权益得到最大限度的保护。
一、国家药物临床试验机构基本信息
|
机构主任
|
张才忠
|
|
机构办公室主任
|
杜梓毓
|
|
机构办公室副主任
|
曾 涌
|
|
机构办公室秘书
|
李琳琳
|
|
备案专业
|
心血管内科、泌尿外科、妇科、呼吸内科、神经外科
|
|
备案号
|
药临床机构备字2021000131
|
|
备案时间
|
2021.10.30
|
二、备案专业基本情况
|
专业名称
|
主要研究者
|
职称
|
|
心血管内科
|
陈 瑛
|
副主任医师
|
|
泌尿外科
|
唐驱波
|
副主任医师
|
|
妇 科
|
曾玉霞
|
副主任医师
|
|
呼吸内科
|
唐 涛
|
副主任医师
|
|
神经外科
|
雷 国
|
副主任医师
|
机构办公室电话:0735-2479554/0735-2479021
传 真:0735-2479554
机构办邮箱:csygcp@126.com
伦理委员会办公室电话:0735-2479567
传 真:0735-2479567
伦理委员会邮箱:czsyirb@163.com
注册药物临床试验立项审查文件清单
|
序号
|
分类
|
文件名称
|
备注
|
|
1
|
A类(立项和伦理审查阶段必须要提供的文件)
|
药物临床试验立项与伦理审查申请表
|
按中心要求模板填写和提供(主要研究者签字)
|
|
2
|
研究者手册(版本号,日期)
|
申办者/CRO需签字盖章
|
|
3
|
己签字的临床试验方案(版本号,日期)
|
至少包含申办者签字盖章、本中心主要研究者签字
|
|
4
|
知情同意书样本(版本号,日期)
|
申办者/CRO需签字盖章
|
|
5
|
本中心主要研究者签名的履历和其他资格文件
|
本中心主要研究者签名的履历、GCP证书、执业证书等
|
|
6
|
本中心主要研究者利益冲突声明
|
主要研究者签字
|
|
7
|
申办者的资质(营业执照等)、GMP证书或满足GMP条件的声明
|
委托生产需提供委托生产说明及被委托方资质,(复印件加盖所在方公章)
|
|
8
|
B类(立项和伦理审查阶段原则上需要提供,如有特殊情况可在试验启动前或试验过程中后补的文件)
|
药品监督管理部门对临床试验方案的许可或备案文件
|
NMPA批件或临床试验通知书等,中心同意前置伦理审查的,或生物等效性临床试验,可在试验启动前提供(复印件加盖所在方公章)
|
|
9
|
组长单位的伦理批件和成员表
|
适用于本中心为参与单位,但本中心伦理同意提前审查可暂时不提供(申办者/CRO需签字盖章)
|
|
10
|
试验用药品检验报告
|
特殊情况暂时不能提供的需出具试验用药品合格的声明,在寄送药品时必须提供对应批号的检验报告(复印件加盖申办方/CRO公章)
|
|
11
|
病例报告表(或EDC)样本(版本号,日期)
|
特需情况暂时不能提供的,需要在启动前提供并完成伦理备案(申办者/CRO需签字盖章)
|
|
12
|
C类(适用于项目涉及到的文件,如适应需提供:项目不涉及,则不需要提供)
|
除知情同意书外,其他提供给受试者的任何书面资料
|
如有,需提供。如受试者须知等宣教材料,受试者日记卡,受试者评分表等
|
|
13
|
招募受试者的方式和相关信息文件
|
如招募广告等,含版本号、版本日期,需注明发布渠道(申办者/CRO需签字盖章)
|
|
14
|
受试者保险的相关文件
|
如有,需提供。证明受试者发生与试验相关损害时,可获得补偿或赔偿(原件)
|
|
15
|
CR0相关方资质证明文件及委托函
|
适用于委托CRO时,需提供,包括但不限于企业三证、委托函等(复印件加盖所在方公章)
|
|
16
|
中心实验室或第三方实验室资质及室间质评证书
|
适用于委托中心实验室或第三方实验室时,需提供
|
|
17
|
盲法试验的揭盲程序文件
|
适用于未在试验方案中说明,需单独提供
|
|
18
|
安慰剂对照说明
|
适用于选择安慰剂作为对照情况,需提供选择安慰剂作为对照的原因说明(加盖申办方/CRO公章)
|
|
19
|
研究病历样表(版本号,日期)
|
原则上不需提交研究病历,如项目已有设计,且研究中心计划使用,需向中心提交(申办者/CRO需签字盖章)
|
|
20
|
D类(各中心特殊要求文件)
|
各中心根据需要要求提供的其他文件
|
临床试验机构/伦理委员会SOP规定的其他特殊文件
|
备注: 1.所有文件按此表顺序递交,不得自行删减。
2.申办方提供的资料均需盖章后递交(如盖章为临床试验专用章,需要提供盖章说明,与公章具有同等效力)。
3.需提供纸质版一份交机构办公室,电子版一份发送至机构办邮箱:csygcp@126.com。
研究者简历Researcher Resume
|
姓名Name
|
|
出生日期Date of Birth
|
|
|
职务 Position
|
|
职称Professional Title
|
|
|
科室专业 Department
|
|
工作单位Employer
|
|
|
办公电话Phone
|
|
手机号码 Mobile
|
|
|
联系邮箱E-mail
|
|
传真号码 Fax
|
|
|
|
教育经历(自大学起)Education/Training
|
|
|
学校名称University
|
学位Degree
|
毕业时间Graduated Year
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
主要临床研究经验 Research Experiences
|
|
|
研究名称Project
|
研究分期Phase(I-IV)
|
承担任务Role in Trial
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
GCP和伦理培训经历 GCP & Ethics Training Experiences
|
|
|
培训内容Content
|
培训单位Institution
|
培训时间Year
|
|
|
|
|
|
|
|
|
|
|
|
|
相关学术兼职 Related Professional Memberships
|
|
|
专业协会Professional Society
|
职务Title
|
任职时间Year-Year
|
|
|
|
|
|
|
|
|
|
|
|
|
出版论文专著 Published Papers
|
|
|
0
|
1-5
|
6-10
|
10-20
|
>20
|
|
研究者签名Signature 日期Date
药物临床试验立项申请表
|
试验药物
|
|
剂 型
|
|
|
CFDA批件号/NMPA备案号
|
|
|
类 别
|
□中药 □化学药 □生物制品 □进口药
|
第 类
|
|
试验分期
|
□Ⅱ;□Ⅲ;□Ⅳ;□其他
|
|
项目名称
|
|
|
申办单位
|
|
联系人
|
|
|
联系地址
|
|
联系电话
|
|
|
CRO(如有)
|
|
联系人
|
|
|
联系地址
|
|
联系电话
|
|
|
预计试验时间
|
年 月 日 至 年 月 日
|
|
试验组长单位
|
|
试验总例数
|
|
|
专业科室
|
|
主要研究者
|
|
拟承担例数
|
|
|
研究者正在开展和已经完成的临床试验项目
|
目前 项 完成 项
|
|
生物样本转运情况
|
□不转运 □运往中心实验室 □出境
|
|
主要研究者声明:
本人已详悉项目相关资料,同意承接该临床试验项目。
作为项目第一责任人,本人承诺在试验全过程,研究小组将严格遵循《药物临床试验质量管理规范》和我院国家药物临床试验机构相关规定,充分保障受试者合法权益,保证项目真实、完整、规范地进行,并按合同完成试验任务。
签名: 年 月 日
|
|
专业负责人意见:
□ 同意 □ 不同意
签名: 年 月 日
|
|
机构办公室审查意见:
□ 同意 □ 不同意
签名: 年 月 日
|
|
机构负责人审批意见:
□ 同意 □ 不同意
签名: 年 月 日
|
|



